A aplicação de técnicas de sequenciamento genético para avaliar a composição do microbioma humano promoveu avanço extraordinário na compreensão das relações íntimas e de dupla mão de direção entre nosso microbioma e genoma (SENDER, FUCHS, MILO, 2016).
O intestino, em especial o grosso, abriga a maior quantidade de bactérias de nosso microbioma, que interagem conosco na dependência da dieta, estilo de vida e genética (SENDER, FUCHS, MILO, 2016).
Esta interação se aplica ao próprio intestino, mas também tem repercussão sistêmica, sob a forma de eixos que envolvem o intestino e a sua microbiota e o fígado, pâncreas, cérebro, pulmão, osso e os sistemas imunológico e endócrino, entre outros (RANJAM et al., 2016).
Em condições conviviais adequadas, temos a situação de normobiose, na qual bactérias comensais e simbiontes encontram-se em equilíbrio com as enteropatogênicas. Na normobiose, nos beneficiamos em termos de reforço da barreira intestinal, tolerância imunológica e da produção de um enorme número de moléculas sintetizadas pela microbiota intestinal (RANJAM et al., 2016).
No entanto, em condições adversas, como dieta inadequada, sedentarismo, uso de tabaco e álcool, estresse físico e emocional, enfermidades, uso de antibióticos e outros medicamentos, entre outros condicionantes, podemos encontrar a situação de disbiose, na qual prevalecem as bactérias enteropatogênicas sobre as simbióticas e comensais. Na disbiose, aumenta a permeabilidade intestinal, pode ocorrer translocação de microrganismos e moléculas inadequadas e se estabelece uma resposta inflamatória cuja intensidade pode depender do tipo e intensidade da prevalência de bactérias patogênicas. Com isso, perdemos os benefícios da normobiose (NIEUWDORP et al., 2014).
Na prática, a composição da microbiota intestinal pode ser obtida pelo sequenciamento do gene 16S rRNA. A amostra fecal tem o seu DNA extraído, limpo de produtos contaminantes e sequenciado nas suas regiões hipervariáveis deste gene. Após a detecção das sequências, realiza-se montagem e análise dos dados, o que permite taxonomisar as bactérias em filo, classe, ordem, família, gênero e espécie (em torno de 50%).
O maior conhecimento da composição da microbiota bacteriana intestinal permitiu estabelecer associações entre distintas assinaturas microbiológicas na saúde e na doença. A adição da metabolômica – análise dos metabólitos – permitiu identificar milhares de pequenas moléculas produzidas pelas bactérias intestinais, que interagem com nosso metabolismo e genes. A junção do metaboloma bacteriano com o nosso pode ser entendida como metaboloma sistêmico. Com isso, se progrediu no entendimento de mecanismos pelos quais a microbiota intestinal interage com o hospedeiro em diferentes condições de saúde e doença (CANI, 2017).
No período pré-operatório, por exemplo, observou-se que a microbiota intestinal está alterada em pacientes com câncer de cólon. Verificou-se aumento da diversidade microbiana mucosa e abundância diferencial de taxas bacterianas específicas quando comparado com indivíduos controles sem câncer. Microrganismos patógenos associados à boca estão super-representados em tumores de cólon e tendem a ocorrer simultaneamente. Salienta-se a maior presença de Peptostreptococcus na mucosa intestinal e fezes, que poderá vir a ser um biomarcador de câncer colorretal (HIBBERD et al., 2017).
Conhecer e modular a microbiota intestinal pode ajudar a reduzir riscos ou contribuir para alterar o curso clínico de algumas enfermidades (KREZALEK et al., 2016). O doente cirúrgico, em particular, é distinto porque para o tratamento de sua enfermidade vai sofrer um trauma anestésico-cirúrgico cuja evolução desfavorável pode ser atribuída a alterações na microbiota intestinal (KREZALEK et al., 2016).
Admite-se que, em condições normais, a microbiota intestinal contribui para resistência contra microrganismos patogênicos. Mas o estresse fisiológico da lesão cirúrgica sobre o trato gastrintestinal pode modificar a abundância e função da microbiota intestinal em um indivíduo já enfermo (KREZALEK et al., 2016).
Pouco se sabe, ainda, sobre a condição da microbiota no período pós-operatório, mas é possível que, em consequência do trauma, as bactérias intestinais possam se tornar mais virulentas e contribuir para o desenvolvimento de complicações cirúrgicas (KREZALEK et al., 2016).
As perturbações fisiológicas do estresse cirúrgico, em associação com limpeza intestinal do colón, uso profilático de antibióticos, tipo e duração da intervenção cirúrgica, hipóxia e falta de nutrientes na luz intestinal, podem modificar o equilíbrio microbiano intestinal (KREZALEK et al., 2016).
Em particular, a limpeza exaustiva do cólon está associada à redução da camada de muco, diminuição da produção de ácidos graxos de cadeia curta, modificação do pH intraluminal e aumento de Proteobactérias (KREZALEK et al., 2016).
Existem fatores associados ao hospedeiro no período intra-operatório, como a condição de isquemia e reperfusão, e presença de catecolaminas em função da resposta orgânica ao trauma. No intestino, pode ocorrer diminuição da produção de muco e diferentes consequências do manuseio, ressecção e restituição epitelial perante as anastomoses digestivas (GERSHUNI; FRIEDMAN, 2019).
Experimentalmente, observou-se que, mesmo quando transitória, a isquemia durante a anastomose intestinal reduz a quantidade de muco intestinal (FERRARO et al., 1995). A isquemia intestinal também pode ativar as substâncias adenosina e dinorfina que, por sua vez, são pressentidas pelas bactérias por meio de sensores tipo sensum quorum. Neste caso, a Pseudomonas aeruginosa se converte em um fenótipo mais agressivo. Assim, aumenta sua atividade de degradação de colágeno e promove maior permeabilidade intestinal nas junções espessas das células epiteliais intestinais.
Alguns medicamentos também podem contribuir para modificar o comportamento de bactérias. Um exemplo é a morfina, que modifica negativamente o fenótipo da P. aeruginosa para degradar muco e reduzir a integridade epitelial (BABROWSKI et al., 2012).
Ainda, solutos químicos, produzidos durante a feitura da anastomose intestinal, atraem micróbios e células imunes para o sítio, e enviam sinais que induzem mudanças fenotípicas em Pseudomonas e Enterococcus (BABROWSKI et al., 2012).
Em condições de difícil dissecção, por exemplo para a remoção de cânceres, pode ocorrer perda sanguínea que exija transfusão e maior tempo intra-operatório. Isto pode promover a liberação de sinais compensatórios no hospedeiro com manifestação local na área operatória. A microbiota local é capaz de captar estes sinais, e processá-los de modo a aumentar a sua capacidade de aderência ao tecido e aumentar sua produção de colagenase. Em etapa subsequente, esta modificação da microbiota pode estar associada com a deiscência mediada por bactérias (GAINES, 2018).
As bactérias Enterococcus faecalis, muito prevalentes em anastomose intestinal, produzem a enzima gelatinase, que degrada colágeno e ativa metaloproteinases de matriz intestinal, capazes de degradar colágeno e contribuir para a deiscência da anastomose (GUYTON; ALVERDY, 2017).
Redução da presença de disbiose
No período pré-operatório, poderíamos considerar evitar o preparo de cólon, quando possível, e refinar o uso de antibióticos profiláticos por suas consequências prejudiciais para a microbiota residente.
No período intraoperatório, manter sempre técnica cirúrgica apurada, evitar sangramentos e transfusões sanguíneas, manipular os tecidos com delicadeza, executar anastomoses digestivas dentro do maior padrão técnico e optar, sempre que possível, por vias de acesso menos traumáticos e de menor impacto inflamatório.
Dentre as distintas possibilidades de se modificar a composição da microbiota intestinal, destacam-se os prebióticos, probióticos e simbióticos, cujo consumo tem aumentado exponencialmente na última década.
Os probióticos são definidos pela FAO/WHO como organismos vivos que, ingeridos na quantidade adequada, conferem benefícios para a saúde do hospedeiro (HILL et al., 2014).
No Brasil, probióticos em geral estão incluídos, pela ANVISA, na categoria de alimentos. Dentre os mecanismos de ação dos probióticos podemos citar: competição por nutrição; bioconversão de nutrientes – a conversão de açúcar em ácido lático, por exemplo, torna o ambiente intestinal inóspito para bactérias patogênicas que preferem meios mais alcalinos; produção de substratos, entre eles vitaminas B e K e ácidos graxos de cadeia curta; antagonismo direto pela produção de substâncias bactericidas (bacteriocinas); exclusão competitiva; redução de inflamação e promoção de tolerância imunológica e modulação do sistema imune.
É de suma importância conhecer a espécie e a cepa de cada probiótico que se pretende utilizar, uma vez que probióticos de mesmo gênero, mas de espécies diferentes, estão associados a distintos efeitos no organismo humano. A cepa garante a segurança do probiótico e a obtenção do efeito alegado.
Em cirurgia, as bases fisiopatológicas e clínicas para uso de probióticos encontram-se descritas no quadro abaixo.
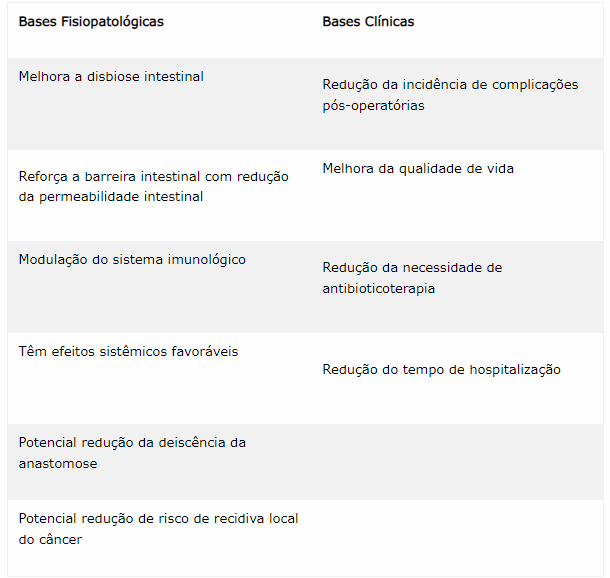
A oferta de probióticos (Bifidobacterium lactis Bl-04, e Lactobacillus acidophilus NCFM) no pré-operatório de pacientes com câncer colorretal modificou a assinatura microbiana tipicamente associada. Ocorreu enriquecimento de bactérias produtoras de butirato no tecido intestinal. Este estudo sugere que a disbiose microbiana do câncer colorretal pode ser manipulada por probióticos (HIBBERD et al., 2017).
Prebióticos alimentares foram definidos pela Associação Científica Internacional de Probióticos e Prebióticos (ISAPP) em ingredientes seletivamente fermentados, que resultam em alterações específicas na composição e/ou atividade da microbiota gastrintestinal, e proporcionam benefícios para a saúde do hospedeiro (GIBSON et al., 2011). Dentre eles se destacam os fruto-oligossacarídeos (FOS) que podem promover crescimento de bifidobactérias e lactobacilos benéficos no cólon.
Simbióticos consistem em produtos que combinam em uma mesma formulação os alimentos prebióticos e probióticos. Um exemplo disponível no Brasil é a mistura de FOS com Lactobacillus acidophilus, Lactobacillus paracasei, Lactobacillus rhamnosus e Bifidobacterium lactis.
Esta formulação de simbiótico foi estudada, entre nós, no pré-operatório de cirurgia do câncer colorretal. De fato, em estudo duplo-cego, aleatório e randomizado, 73 pacientes candidatos à cirurgia para remoção de câncer colorretal foram separados em grupo controle e simbiótico. O último teve consumo de dois sachês do simbiótico, no período pré-operatório, por 7 dias. Houve associação com menores níveis de marcadores inflamatórios, menor taxa de complicações cirúrgicas, menor uso de antibióticos, menor tempo de hospitalização e ausência de mortalidade comparado ao grupo placebo (POLAKOWSKI et al., 2019).
O uso de probióticos e simbióticos em cirurgia eletiva foi avaliado por uma metanálise (KINROSS, 2013) que verificou a existência de menos infecções, menos antibioticoterapia e menos sepsis pós-operatória com seu uso e, consequentemente, menos dias de internação hospitalar.
Em resumo, a composição da microbiota intestinal pode estar alterada no doente cirúrgico do aparelho digestivo por razões inerentes ao paciente, ao procedimento cirúrgico e à própria microbiota. Intervenções com prebióticos, probióticos e simbióticos poderão ser úteis para redução de morbidade pós-operatória.
Com o enorme desenvolvimento dos conhecimentos nesta área, o cirurgião em muito poderá beneficiar seus pacientes ao conhecer as alterações e a modulação da microbiota e sua metagenômica.
Dan L. Waitzberg é professor associado do Departamento de Gastroenterologia da FMUSP
Artigo publicado na edição 710 da Revista da APM – maio/2019
—————————————————————————————————
REFERÊNCIAS
Babrowski T; Holbrook C; Moss J. et al. Pseudomonas aeruginosa virulence expression is directly activated by morphine and is capable of causing lethal gut-derived sepsis in mice during chronic morphine administration. Ann Surg. 2012; 255(2):386-93.
Cani, PD. Gut microbiota – at the intersection of everything? Nat Rev Gastroenterol Hepatol. 2017; 14(6):321-322.
Ferraro FJ; Rush BF; Simonian GT. et al. A comparison of survival at different degrees of hemorrhagic shock in germ-free and germ-bearing rats. Europe PMC. 1995; 4(2):117-120.
Gaines S, Shao C, Hyman N, Alverdy JC. Gut microbiome influences on anastomotic leak and recurrence rates following colorectal cancer surgery. Br J Surg. 2018 Jan;105(2):e131-e141. doi: 10.1002/bjs.10760.
Gershuni VM; Friedman ES. The Microbiome-Host Interaction as a Potential Driver of Anastomotic Leak. Current Gastroenterology Reports. 2019.
Gibson, G.R., et al. Dietary prebiotics: current status and new definition. IFIS Functional Foods Bulletin. 2011;7:1-19.
Guyton K; Alverdy JC. The gut microbiota and gastrointestinal surgery. Nature Reviews Gastroenterology & Hepatology. 2017; 14: 43–54.
Hibberd AA; Lyra A; Ouwehand AC. et al. Intestinal microbiota is altered in patients with colon cancer and modified by probiotic intervention. BMJ Open Gastroenterol. 2017; 3;4(1):e000145.
Kinross JM1, Markar S, Karthikesalingam A, Chow A, Penney N, Silk D, Darzi A. A meta-analysis of probiotic and synbiotic use in elective surgery: does nutrition modulation of the gut microbiome improve clinical outcome? JPEN J Parenter Enteral Nutr. 2013 Mar;37(2):243-53.
Krezalek MA; Skowron KB; Guyton KL. et al. The intestinal microbiome and surgical disease. Curr Probl Surg. 2016; 53(6):257-93.
Nieuwdorp M; Gilijamse PW; Pai N, et al. Role of the microbiome in energy regulation and metabolism. Gastroenterology.2014; 146(6):1525-33.
Polakowski CB, Kato M, Preti VB, Schieferdecker MEM, Ligocki Campos AC. Impact of the preoperative use of synbiotics in colorectal cancer patients: A prospective, randomized, double-blind, placebo-controlled study. Nutrition. 2019; 58:40-46.
Ranjan R; Rani A; Metwally A, et al. Analysis of the microbiome: Advantages of whole genome shotgun versus 16S amplicon sequencing. Biochem Biophys Res Commun. 2016; 22;469(4):967-77.
Sender R; Fuchs S; Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 2016; 14(8): e1002533.






